結晶における原子の結合の種類は5種類に分けられる。
- イオン結合
- 共有結合 ←
- 金属結合
- 分子間結合
- 水素結合
ここでは共有結合結晶をみていきたい。イオン結合よりも電子の所在がはっきりしていない結合である。SiとGaAsを例にその結合の様子を見る。
目次
1. Siの例(高校レベル)
Si(ケイ素)は原子番号14であり、価電子数は4である。同族の元素には、原子番号6のC(炭素)や原子番号32のGe(ゲルマニウム)などがあり、価電子数は同じく4である。
1.1 どのように共有結合するか
最外殻軌道には残り4個の電子が入り得るために、Siで結晶を作ると図のように4個の価電子に対して、4個の電子の「空き」がある。Siの最外殻電子は図のオレンジで囲まれた部分で結合し安定化する。
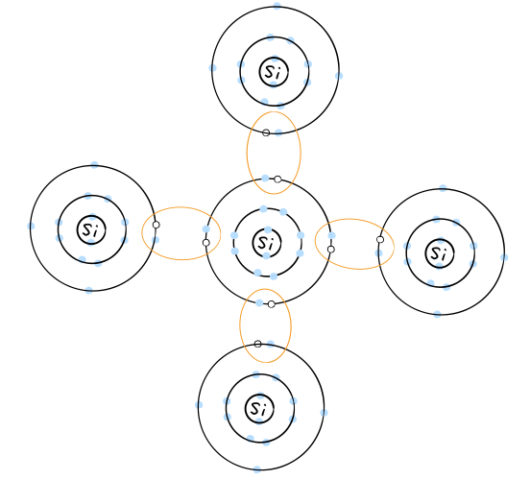
図のような ![]() 殻、
殻、![]() 殻、
殻、![]() 殻で表現するのは不正確であるが、理解しやすいので用いた。理系大学生以上は
殻で表現するのは不正確であるが、理解しやすいので用いた。理系大学生以上は ![]() 混成軌道で考えるべきである。
混成軌道で考えるべきである。
Siが4つの電子をそれぞれ出し合って結合する様子を下に示す。Si-Siの結合であるため、共有された電子対はちょうど真ん中の位置にある。これは後にみるGaAsの場合と異なる。
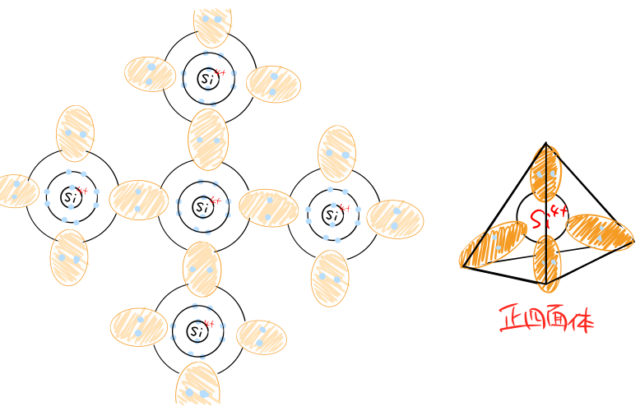
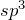 混成軌道)。
混成軌道)。1.2 共有結合結晶の特徴
共有結合結晶の特徴をまとめておく。
- 結合力が強い
- 融点が高い(ダイヤモンド:3572℃、ケイ素1414℃)
- 電気伝導性はない(グラフェンなどを除く)
- 硬い
イオン結晶と同じく共有結合は安定である。したがって融点が高くなる。また、グラフェンなどの例外を除いて電場によって電子が動くこともないため電気伝導性はない。
Siに電気伝導性があるように見えるのは不純物によって電子が多かったり少なかったりするためである。Siは不純物をドーピングして![]() 型や
型や![]() 型の半導体として利用することが多い。
型の半導体として利用することが多い。
周期表でSiの下にあるGeは同じく共有結合をとる。しかし、原子半径が大きいなど理由から共有結合の束縛はゆるく、Siに比べて融点は938℃と低い。
2. GaAsの例
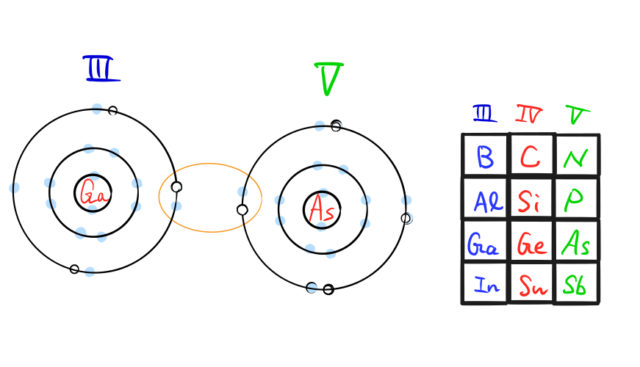
GaAs(ガリウム砒素)は同じく共有結合をつくる。周期表では原子番号32のGeの両隣にある。価電子数が4であるGeを、電子が1つ少ないGaと電子が1つ多いAsで置き換えた形になっている(このような置き換えはカルコパイライト型の太陽電池などでも見られる)。
- Gaは価電子数:3
- Asは価電子数:5
であることからGaAsのような価電子の組み合わせをもつ半導体をⅢ-Ⅴ族半導体と呼ぶ。
周期表からⅢ-Ⅴ族の例として、GaP、InAs、ZnSなども挙げられる。結晶構造はダイヤモンド型構造によく似ているが、炭素が3価と5価の原子に置き換わった構造をとる。いわゆる閃亜鉛鉱型(ジンクブレンド型)構造をとりやすい。
2.1 どのように結合するか
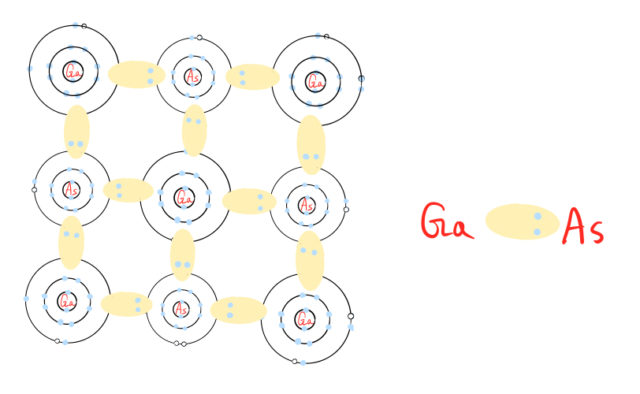
同じ種類の原子の間での共有結合ではないため、共有電子対はイオン結合のようにどちらかに「引っ張られる」ことになる。今の場合、原子番号の大きく電気陰性度の大きいAs側に引っ張られる。
電気陰性度の大きさは周期表の右上ほど大きい(F>O>Nの順で大きい)。理由はおおよそ以下の通り。
- 周期表の上:同族では電子と原子核の陽子との距離が近いほうが電子を強く引きつける
- 周期表の右:同周期では原子核の陽子数が多いほど電子を強く引きつける
As側に共有電子対がよることを考慮して、下図に共有結合のイメージを描いた。
2.2 応用的な視点
Ⅲ-Ⅴ族のGaAsなどはAsの一部をPに置き換えて GaAs![]() P
P![]() を作ってみたりしてバンドギャップを制御することが行われている(バンドギャップエンジニアリング)。バンドギャップは光の吸収や発光に重要な物性値であり、このようなバンドギャップの制御は太陽電池材料の開発やLEDなどの研究に重要である。
を作ってみたりしてバンドギャップを制御することが行われている(バンドギャップエンジニアリング)。バンドギャップは光の吸収や発光に重要な物性値であり、このようなバンドギャップの制御は太陽電池材料の開発やLEDなどの研究に重要である。
Ⅲ-Ⅴ族の他にも周期表をさらに広げて価電子数2と6の組み合わせでⅡ-Ⅵ族半導体を作ることも可能である。ただしⅡ-Ⅵ族半導体はイオン結合性が強くもろい。
2.3 構造安定性(発展)
発展的な内容として結晶の構造安定性を考える。先ほど、ZnSなどは閃亜鉛鉱型をとるとしたが、ZnSは別の六方晶系のウルツ鉱型構造がある。したがってⅢ-Ⅴ族半導体やⅡ-Ⅵ族半導体が一概に閃亜鉛鉱型をとるわけではない。
閃亜鉛鉱型構造の相安定性の目安は、共有結合性が強いかどうかだと考えられる。詳細な研究は以下を参考にされたい。
3. イオン結合と共有結合を見分ける
共有結合を見てきた。イオン結合との違いは電子の行き先がはっきりしているかどうかであった。GaAsなどではSiに比べてイオン結合性が強いとも言える。
イオン結合であるか共有結合であるかを見分けるには、電子を引きつける強さの指標である電気陰性度の差を見れば良い。
- イオン結合:電気陰性度の差が大きい
- 共有結合:電気陰性度の差が小さい
電気陰性度の差が2以上ならイオン結合とみなしてよい。1.7くらいでもほぼイオン結合だろう。1より小さい場合は共有結合性が強いと言えます。
微妙な領域についてははっきりとした基準がないために、
- イオン結合性〇〇%、共有結合性〇〇%
- イオン結合よりの共有結合
のような曖昧な表現になってしまいます。このような中間的な性質をもった結合については試験などで問題になることはないです。
注意として陽イオンとなる原子も少なからず電子を引きつけるため(電気陰性度が0でないため)、電子の偏りが100% 陰イオンに寄っていることはない。したがってイオン結合性100%はない。
4. まとめ
SiとGaAsを例に共有結合を見てきた。イオン結合や他の結合との違いなど確認しながら学ぶのがよい。